Метаболизм гомоцистеина при сепсисе
#Метаболизм_гомоцистеина #сепсис
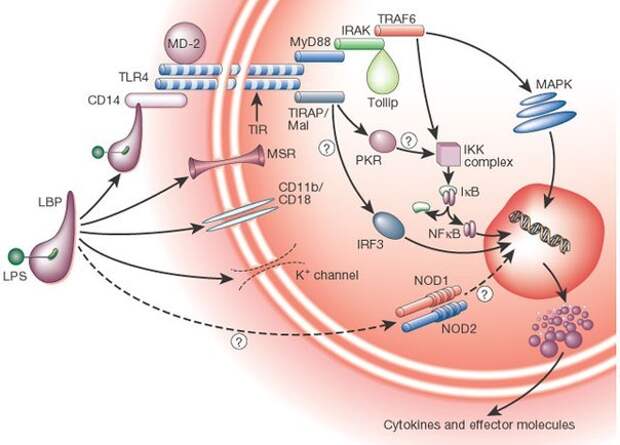
Сепсис в современном обществе в связи с неуклонным ростом заболеваемости становится все более актуальной и пока не достаточно изученной проблемой медицинской науки. Обусловлено это объективными факторами, такими как увеличение количества инвазивных вмешательств, постарение населения, увеличение числа людей с хроническими заболеваниями, нарушения в иммунной системе и многие другие. Многочисленные исследования по изучению патогенеза и поиску новых путей решения этой проблемы не привели к снижению летальности от сепсиса, которая остается стабильно высокой – от 30 до 80%. [5]. Патогенез сепсиса включает изменения, возникающие в организме в результате неконтролируемого выброса цитокинов и других эндогенных медиаторов воспаления [13].
Для патогенеза сепсиса характерно также нарушение функционирования многих регулирующих гомеостаз систем. Это проявляется образованием токсических соединений и накоплением в аномально высоких концентрациях продуктов метаболизма, таких как лактат, пируват, креатинин, различных альдегидов, кетонов, биогенных аминов, лизосомальных белков и ферментов, цитокинов, продуктов перекисного окисления липидов, оксида азота, протеаз, свободных радикалов, иммунных комплексов, иммуноглобулинов и многих других [13, 16]. Сепсис имеет сходные звенья в патогенезе с сердечнососудистыми заболеваниями, так как в обоих случаях развивается эндотелиальная дисфункция, оксидативный стресс, нарушение гемостаза и обмена веществ [10, 12, 15, 19, 21]. О роли гомоцистеина при кардиоваскулярной патологии написано много статей и книг, а об изменении данной аминокислоты и ее метаболитов при сепсисе имеются лишь единичные публикации. В одном из немногочисленных исследовании у пациентов с политравмой, которая осложнялась сепсисом, было выявлено увеличение уровня гомоцистеина. Интересная закономерность прослеживалась относительно исхода сепсиса и концентрации гомоцистеина. У умерших пациентов уровень гомоцистеина был выше, чем у выживших [7].
При сепсисе происходит изменение обмена метионина и нарушение процессов трансметилирования [16]. Одним из образующихся при этом цитотоксичных метаболитов является гомоцистеин (Hcy). Накопление гомоцистеина в организме происходит как следствие дисбаланса между уровнем его наработки (S-аденозилметионин(SAM)-зависимые реакции) и удаления (реметилирование или транссульфурирование, выделение почками) [2, 16]. При сепсисе имеет место наработка в высоких количествах оксида азота, который является одним из известных ингибиторов ферментов транссульфурирования [13, 23]. Повышение гомоцистеина относят к факторам риска, участвующим в формировании дисфукнкции эндотелия сосудов, активации пролиферации гладкомышечных клеток, а также активации тромбоцитов и лейкоцитов [12]. В опытах, проведенных на животных, отмечено усиление гиперплазии неоинтимы после повреждения сосуда при высоком уровне гомоцистеина [10]. Некоторые исследователи указывают на то, что гомоцистеин влияет на функцию тканевого активатора плазминогена, стимулирует факторы свертывания (V, X, XII) и агрегацию тромбоцитов, а также ингибирует функцию естественных антикоагулянтов, таких как антитромбин III и протеин С [21]. На клеточном уровне гомоцистеин оказывает воздействие на активность процессов метилирования ДНК и протеинов, повышает экспрессию провоспалительных цитокинов, индуцирует оксидативный стресс [2]. Оксидативный стресс при гипергомоцистеинемии возникает в силу нескольких причин, во-первых, вследствие подавления ферментов-антиоксидантов (супероксид дисмутаз, глутатион пероксидазы, тиоредоксина) [19]. Во-вторых, из-за ингибирования Zn(II) содержащего фермента NG,NG-диметиларгинин диметиламиногидролазы (DDAH, EC 3.5.3.18), расщепляющего асимметричный диметиларгинин (aDMA), избыток которого ведет к ингибированию NO-синтаз (NOS) и способствует выработке большого количества свободных радикалов кислорода. Кроме того, гомоцистеин повышает чувствительность клетки к цитотоксическому действию агентов, способных генерировать свободные радикалы [19].
Втретьих, при гипергомоцистеинемии имеет место активация экспрессии прооксидантных ферментов, в том числе – НАДФН-оксидазы (Nox). Повышенные концентрации гомоцистеина при отсутствии достаточной антиокислительной защиты приводят к накоплению активных форм кислорода, следствием чего является дегенерация и фрагментация ДНК, активация поли(АДФ)-рибоза-полимеразы, истощение энергетических запасов клетки, высвобождение цитохрома C из митохондрий и активация проапоптозного каскада семейства каспаз, и в итоге – апоптоз / некроз клетки [2]. Общая концентрация гомоцистеина в плазме крови состоит из свободного (< 1%), связанного с белками (~ 80% связано с альбумином) и представленного в форме дисульфидов (цистин, Hcy-Cys и проч.), поэтому элиминация связанного гомоцистеина представляет некоторые трудности [9]. Так как гипергомоцистеинемия является повреждающим фактором при многих состояниях, активно изучаются возможности ее коррекции. Наиболее доступными факторами снижения уровня гомоцистеина являются витамины B2, В6, В12 и фолиевая кислота [2]. В ряде случаев это ведет к улучшению течения заболеваний, в частности ИБС [2]. Что же касается сепсиса, то в ответ на патогенетическое изменение пролиферативной активности лейкоцитов, в эксперименте, наблюдается дозозависимый рост концентрации гомоцистеина в среде инкубации, достигая 600% по сравнению с базовой величиной [11]. Интересно, что этот эффект подавляют противовоспалительные препараты – ацетилсалициловая кислота и ингибитор 3-гидрокси-3-метилглутарил коэнзим А редуктазы – аторвастатин [3, 4].
#Метаболизм_гомоцистеина #сепсис
Сепсис в современном обществе в связи с неуклонным ростом заболеваемости становится все более актуальной и пока не достаточно изученной проблемой медицинской науки. Обусловлено это объективными факторами, такими как увеличение количества инвазивных вмешательств, постарение населения, увеличение числа людей с хроническими заболеваниями, нарушения в иммунной системе и многие другие. Многочисленные исследования по изучению патогенеза и поиску новых путей решения этой проблемы не привели к снижению летальности от сепсиса, которая остается стабильно высокой – от 30 до 80%. [5]. Патогенез сепсиса включает изменения, возникающие в организме в результате неконтролируемого выброса цитокинов и других эндогенных медиаторов воспаления [13].
Для патогенеза сепсиса характерно также нарушение функционирования многих регулирующих гомеостаз систем. Это проявляется образованием токсических соединений и накоплением в аномально высоких концентрациях продуктов метаболизма, таких как лактат, пируват, креатинин, различных альдегидов, кетонов, биогенных аминов, лизосомальных белков и ферментов, цитокинов, продуктов перекисного окисления липидов, оксида азота, протеаз, свободных радикалов, иммунных комплексов, иммуноглобулинов и многих других [13, 16]. Сепсис имеет сходные звенья в патогенезе с сердечнососудистыми заболеваниями, так как в обоих случаях развивается эндотелиальная дисфункция, оксидативный стресс, нарушение гемостаза и обмена веществ [10, 12, 15, 19, 21]. О роли гомоцистеина при кардиоваскулярной патологии написано много статей и книг, а об изменении данной аминокислоты и ее метаболитов при сепсисе имеются лишь единичные публикации. В одном из немногочисленных исследовании у пациентов с политравмой, которая осложнялась сепсисом, было выявлено увеличение уровня гомоцистеина. Интересная закономерность прослеживалась относительно исхода сепсиса и концентрации гомоцистеина. У умерших пациентов уровень гомоцистеина был выше, чем у выживших [7].
При сепсисе происходит изменение обмена метионина и нарушение процессов трансметилирования [16]. Одним из образующихся при этом цитотоксичных метаболитов является гомоцистеин (Hcy). Накопление гомоцистеина в организме происходит как следствие дисбаланса между уровнем его наработки (S-аденозилметионин(SAM)-зависимые реакции) и удаления (реметилирование или транссульфурирование, выделение почками) [2, 16]. При сепсисе имеет место наработка в высоких количествах оксида азота, который является одним из известных ингибиторов ферментов транссульфурирования [13, 23]. Повышение гомоцистеина относят к факторам риска, участвующим в формировании дисфукнкции эндотелия сосудов, активации пролиферации гладкомышечных клеток, а также активации тромбоцитов и лейкоцитов [12]. В опытах, проведенных на животных, отмечено усиление гиперплазии неоинтимы после повреждения сосуда при высоком уровне гомоцистеина [10]. Некоторые исследователи указывают на то, что гомоцистеин влияет на функцию тканевого активатора плазминогена, стимулирует факторы свертывания (V, X, XII) и агрегацию тромбоцитов, а также ингибирует функцию естественных антикоагулянтов, таких как антитромбин III и протеин С [21]. На клеточном уровне гомоцистеин оказывает воздействие на активность процессов метилирования ДНК и протеинов, повышает экспрессию провоспалительных цитокинов, индуцирует оксидативный стресс [2]. Оксидативный стресс при гипергомоцистеинемии возникает в силу нескольких причин, во-первых, вследствие подавления ферментов-антиоксидантов (супероксид дисмутаз, глутатион пероксидазы, тиоредоксина) [19]. Во-вторых, из-за ингибирования Zn(II) содержащего фермента NG,NG-диметиларгинин диметиламиногидролазы (DDAH, EC 3.5.3.18), расщепляющего асимметричный диметиларгинин (aDMA), избыток которого ведет к ингибированию NO-синтаз (NOS) и способствует выработке большого количества свободных радикалов кислорода. Кроме того, гомоцистеин повышает чувствительность клетки к цитотоксическому действию агентов, способных генерировать свободные радикалы [19].
Втретьих, при гипергомоцистеинемии имеет место активация экспрессии прооксидантных ферментов, в том числе – НАДФН-оксидазы (Nox). Повышенные концентрации гомоцистеина при отсутствии достаточной антиокислительной защиты приводят к накоплению активных форм кислорода, следствием чего является дегенерация и фрагментация ДНК, активация поли(АДФ)-рибоза-полимеразы, истощение энергетических запасов клетки, высвобождение цитохрома C из митохондрий и активация проапоптозного каскада семейства каспаз, и в итоге – апоптоз / некроз клетки [2]. Общая концентрация гомоцистеина в плазме крови состоит из свободного (< 1%), связанного с белками (~ 80% связано с альбумином) и представленного в форме дисульфидов (цистин, Hcy-Cys и проч.), поэтому элиминация связанного гомоцистеина представляет некоторые трудности [9]. Так как гипергомоцистеинемия является повреждающим фактором при многих состояниях, активно изучаются возможности ее коррекции. Наиболее доступными факторами снижения уровня гомоцистеина являются витамины B2, В6, В12 и фолиевая кислота [2]. В ряде случаев это ведет к улучшению течения заболеваний, в частности ИБС [2]. Что же касается сепсиса, то в ответ на патогенетическое изменение пролиферативной активности лейкоцитов, в эксперименте, наблюдается дозозависимый рост концентрации гомоцистеина в среде инкубации, достигая 600% по сравнению с базовой величиной [11]. Интересно, что этот эффект подавляют противовоспалительные препараты – ацетилсалициловая кислота и ингибитор 3-гидрокси-3-метилглутарил коэнзим А редуктазы – аторвастатин [3, 4].